Article contents
Influence of Organic Anions on the Crystallization of Ferrihydrite
Published online by Cambridge University Press: 01 July 2024
Abstract
Hydroxy-carboxylic acids inhibit the crystallization of ferrihydrite in the pH range 9–11 in the order
citric > meso tartaric > L-tartaric ≫ lactic
and favor hematite formation relative to goethite in the order
L-tartaric > citric > meso tartaric > lactic.
The crystal shape of hematite can change from hexagonal plates to acicular in the presence of these acids. The influence of the acids on the crystallization rises with increasing concentration and with falling pH.
The effectiveness in suppressing crystallization depends on whether and how strongly the acid adsorbs on ferrihydrite and how strongly it complexes with Fe3+ in solution. Inhibition of crystallization of hematite is believed to be due to the di- and tricarboxylic acid linking ferrihydrite particles in an immobile network. Goethite formation is suppressed by the acid complexing with Fe in solution and hindering nucleation; strongly adsorbing acids also adsorb on the nuclei and hinder further growth. Certain acids can induce hematite formation because they contain a group which acts as a template for nucleation of hematite.
Резюме
Гидрокси-карбоксильные кислоты препятствуют кристаллизации ферригидрита в диапазоне рН 9–11 в порядке
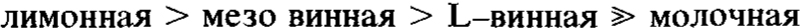
и способствуют образованию гематита относительно гетита в порядке
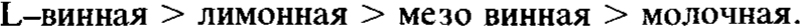
Кристаллическая форма гематита может быть изменена вследствие присутствия этих кислот. Влияние этих кислот на кристаллизацию увеличивается с увеличением концентрации кислоты и с уменьшающейся рН.
Эффективность в подавлении кристаллизации зависит от того, в какой степени кислота адсорбируется ферригидритом и насколько прочные комплексы с Ре3+ она образует в растворе. Предполагается, что кристаллизация гематита затрудняется благодаря связыванию двух- и трех-карбоксильной кислотой ферригидритных частиц в неподвижное соединение. Образование гетита подавляется кислотой, соединяющейся с Ре в растворе и препятствующей образованию ядер кристаллизации; сильно адсорбирующие кислоты также адсорбируются ядрами и препятствуют их дальнейшему росту. Некоторые кислоты могут вызвать образование гематитов потому что они содержат группу, которая способствует образованию центров кристаллизации гематита.
Resümee
Verschiedene Hydroxycarbonsäuren verhindern die Kristallisation des Ferrihydrits zu Goethit und Hämatit im pH-Bereich 9–11 in der Reihenfolge
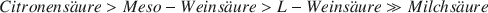
und begünstigen Hämatit auf Kosten von Goethit in der Reihenfolge
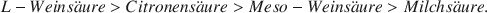
Der Säureeinfluß steigt mit steigender Konzentration und fallendem pH. In Gegenwart der Säuren sind die Hämatitkristalle nicht sechseckig sondern leistenförmig.
Die Unterdrückung der Kristallisation hängt davon ab, wie stark die Säure vom Ferrihydrit adsorbiert wird und wie stark sie das Fe3+ in der Lösung komplexiert. Es wird angenommen, daß die Kristallisation des Hämatits dadurch verhindert wird, daß die organischen Anionen die Ferrihydritteilchen zu einem starren Netzwerk verknüpfen. Die Goethitbildung wird dagegen durch Komplexierung des Fe und Verhinderung der Keimung bzw. des Kristallwachstums gestört. Einige Säuren wirken als “Schablone” fördernd auf die Kristallisation des Hämatits.
Résumé
Les acides hydroxy-carboxyliques inhibent la cristallisation de ferrihydrite sur une étendue de pH de 9 à 11 dans l'ordre
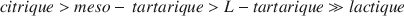
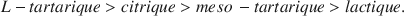
La forme en crystal de l'hématite peut être modifiée par la présence de ces acides. L'influence de ces acides sur la cristallisation croît proportionellement à l'accroissement de la concentration d'acide et au décroisse-ment du pH.
L'efficacité de suppression de la cristallisation dépend de ce que, et comment l'acide adsorbe sur la ferrihydrite et de quel degré il se complexe avec Fe3+ en solution. On croit que l'inhibition de la cristallisation de l'hematite est due à l'acide di- et tricarboxylique liant des particules de ferrihydrite dans un entremeshement immobile. La formation de goethite est réprimée par l'acide se complexant avec Fe en solution et empêchant la nucléation; ces acides fortement adsorbants adsorbent aussi sur les noyaux et empêchent tout accroissement ultérieur. Certains acides peuvent induire la formation d'hématite parce-qu'ils contiennent un groupe qui agit comme moule pour la nucléation de l'hématite.
- Type
- Research Article
- Information
- Copyright
- Copyright © 1979, The Clay Minerals Society
References
- 179
- Cited by


